Pressmeddelande -
WCLC 2022 – lovande data för Lumykras som del i kombinationsbehandling mot KRAS G12C-muterad lungcancer
På just avslutade världskongressen för lungcancer, WCLC 2022, presenterades nya data på KRASG12C-hämmaren Lumykras i lovande kombinationsbehandlingar med såväl signaltransduktionshämmare mot SHP2 som immuncheckpointhämmare.
– Det här är första gången man visar att Lumykras i kombination kan ge varaktig respons oavsett om patienterna tidigare behandlats med immunterapi eller inte, säger docent Jan Nyman, överläkare vid Sahlgrenska Universitetssjukhuset i Göteborg och expert på icke-småcellig lungcancer.
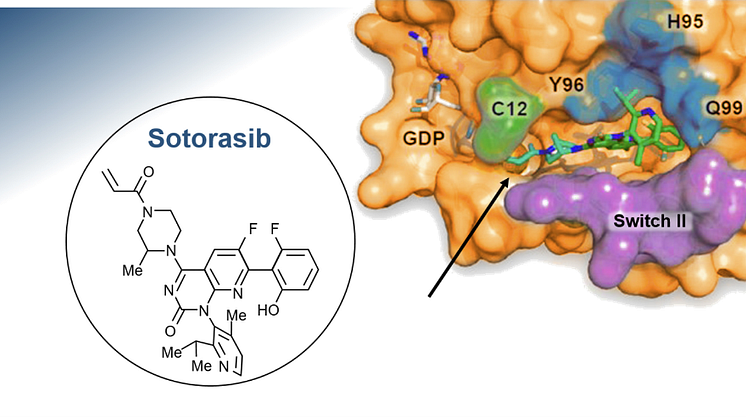
Godkännandet av Lumykras (sotorasib) som den första målriktade behandlingen mot KRAS G12C-muterad icke-småcellig lungcancer (NSCLC) var den första reella framgången efter närmare 40 års fruktlösa försök att ta fram ett läkemedel som specifikt riktas mot KRAS-proteinet (KRAS = Kirsten RAt Sarcoma virus), en av de vanligaste förekommande muterade onkogenerna i solida tumörer.
Emellertid stod det tidigt klart att det, i likhet med många målriktade behandlingar, finns inneboende mekanismer, förvärvade mutationer, som kan leda till resistensutveckling. En av de strategier som potentiellt kan motverka denna utveckling och samtidigt förbättra behandlingseffekten är att kombinera Lumykras med läkemedel som har andra verkningsmekanismer.
På World Conference on Lung Cancer (WCLC) som nyligen hölls i Wien presenterades nya data på två av flera kombinationsstrategier som ingår i masterprotokollet CodeBreak 101-studien inom. KRASG12C-muterad NSCLC. Det gäller dels Lumykras i kombination med immuncheckpointhämning med antingen pembrolizumab (PD-1-hämmare) eller atezolizumab (PD-L1-hämmare), dels Lumykras i kombination med SHP2-hämmaren RMC-4630 (PD-1= Programmed cell death protein 1; PD-L1 = Programmed death-ligand 1): SHP2 = Src homology-2 domain-containing protein tyrosine phosphatase-2).
Lumykras i kombination med immuncheckpointhämmare
I fas 1b-doseringsstudien CodeBreaK 100/101 deltog totalt 58 patienter med KRASG12C-muterad NSCLC. Patienterna, som alla var KRASG12C-hämmarnaiva, delades in i tolv kohorter i olika doser av Lumykras (120–960 mg dagligen) i kombination med intravenöst atezolizumab (1200 mg) eller pembrolizumab (200 mg) administrerat samtidigt var tredje vecka tills intolerans eller sjukdomsprogress. I hälften av kohorterna inleddes behandlingen med Lumykras som monoterapi, så kallad lead-in, i antingen 21 eller 42 dagar innan de fick sin första kombinationsdos. Medianuppföljningstiden var 12,8 månader.
I denna NSCLC-population där majoriteten hade genomgått tidigare behandling med immunterapi resulterade kombinationen i en objektiv tumörrespons (ORR = Objective Response Rate) på 29 procent (17/58 patienter i alla kohorter). Bland de 17 patienterna med bekräftad respons hade fem en observerad responsduration (DOR = Duration of Response) på mer än 10 månader, varav åtta med pågående respons vid data cut-off. Behandlingen ledde också till en högre incidens av behandlingsrelaterade biverkningar av grad 3–4 (TRAE = Treatment-Related Adverse Events) än vad som tidigare observerats med Lumykras som monoterapi, främst förhöjda leverenzymer. I de kohorter där Lumykras utvärderades som lead-in påvisades dock varaktig klinisk aktivitet med färre avbrutna behandlingar och allvarligare biverkningar (grad 3–4 TRAE) jämfört med övriga kohorter. De flesta fallen av hepatotoxicitet inträffade efter andra eller tredje dosen av immunterapi och samtliga kunde hävas.
– Det faktum att man såg en medianduration på hela 17,9 månader och färre biverkningar hos patienter som behandlats med Lumykras som lead-in till kombinationsregimen är hoppingivande och ger värdefull kunskap inför den fortsatta prövningen av behandling i första linjen, säger Jan Nyman och fortsätter:
– Vid kombinationsbehandling är sekvens och dosering extra viktigt. Vid samtidig start och högsta dosnivån var biverkningar med påverkan på leverenzymer påtagliga.
Lumykras i kombination med RMC-4630
På ASCO 2022 presenterades den största utvärderingen av förvärvad resistens mot sotorasib som hittills genomförts. Av analysen kunde man dra slutsatsen att det ofta handlar om genomiska förändringar av så kallade RTK (receptortyrosinkinaser), och att det sannolikt vore meningsfullt att undersöka potentialen av att kombinera sotorasib med hämmare av signalmolekyler uppströms om KRAS.
På WCLC presenterades data från en separat doseringsstudie från fas Ib-studien CodeBreaK 101. I denna behandlades totalt 27 patienter med KRAS G12C-muterade tumörer, varav elva patienter med NSCLC, med Lumykras i standarddos och eskalerande dosnivåer av SHP2-hämmaren RMC-4630. Patienterna hade fått en median av tre tidigare behandlingslinjer, och 41 procent hade genomgått tidigare behandling med KRASG12C-hämmare.
Data visade lovande klinisk aktivitet, framför allt hos sotorasib-naiva patienter. Av de elva NSCLC-patienterna uppnådde tre (27 procent) bekräftad partiell respons (PR) varav två med pågående respons vid tidpunkten för data cut-off. Sju patienter (64 procent) uppnådde sjukdomskontroll (DCR = Disease Control Rate).
Av de sex sotorasib-naiva patienterna observerades en ORR på 50 procent och samtliga uppnådde sjukdomskontroll.
Totalt uppträdde TRAE hos 63 procent av patienterna, de vanligaste var ödem och diarré (30 respektive 26 procent).
– Det här är visserligen tidiga säkerhets- och effektdata på ett begränsat antal patienter, men de stöder utan tvekan fortsatta studier för att utöka behandlingsalternativen för patienter med denna vanliga och svårbehandlade mutation, säger Jan Nyman som är svensk huvudprövare i två sotorasib-studier.
Kort om Lumykras (sotorasib)
Lumyras (sotorasib) är en first-in-class småmolekylhämmare som specifikt och irreversibelt binder till KRASG12C via aminosyran cystein som ersätter glycin när mutationen inträffar. KRASG12C blir på så vis låst i ett inaktivt GDP-bundet tillstånd (GDP = guanosine diphosphate, guanosindifosfat). Detta är möjligt efter att forskarna bakom Lumykras upptäckt en tidigare dold ”räffla” på KRASG12C-proteinet.
För ytterligare information, vänligen kontakta:
Sandra Eketorp Sylvan, medicinsk chef, Amgen, tel: 070–433 57 91
Ämnen
Kategorier
Amgen är ett forskande läkemedelsföretag med fokus på att förbättra hälsan hos patienter med allvarliga sjukdomar. Vi bedriver forskning och utveckling av bioteknologiska originalläkemedel och biosimilarer inom terapiområdena onkologi, hematologi, osteoporos, inflammation, kardiologi och nefrologi. Globalt är vi över 25 000 medarbetare, varav cirka 110 arbetar i Sverige. Det svenska kontoret finns i Solna, Stockholm.