Nyhet -
Nye metoder for overvåkning av oppdrettsnæringens miljøeffekter på havbunnen
I prosjektet "AQUAeD" samarbeider Aqua Kompetanse, STIM, Akvaplan-niva, Havforskningsinstituttet og NMBU om å utvikle en ny og bedre metode for overvåking av oppdrettsnæringens miljøeffekter på havbunn.
Metoden baserer seg på å sekvensere DNA fra prøver både fra bløt- og hard havbunn. DNA-sekvensene gir en oversikt over hvilke bakterier som finnes i miljøet. Fordi det allerede finnes kunnskap om hva ulike bakterietyper liker å spise, kan en oversikt over alle bakterietyper i en sedimentprøve fra havbunnen gi direkte informasjon om hvilke næringsstoffer som er til stede og biokjemiske prosesser. Denne informasjonen gir en god beskrivelse av miljøstatusen i et område.
De lovpålagte miljøundersøkelsene som i dag utføres for å måle effekten fra et oppdrettsanlegg på bunnmiljøet, gjennomføres etter standardiserte metoder. Noen av disse metodene er svært tidkrevende og krever en kompetanse som kun et fåtall personer besitter. Knapphet på ressurser og kvalifisert personell har derfor blitt en flaskehals for gjennomføring av miljøovervåking i havbruk. Dagens metode er heller ikke egnet for lokaliteter plassert i områder med hard havbunn.
Samarbeidspartnerne i AQUAeD-prosjektet utfører nå miljøundersøkelser over hele landet med fokus på å sammenligne dagens overvåkningsmetode og DNA-sekvensering i et stort antall bunnprøver. Målsettingen med dette er å utvikle en ny standard for miljøundersøkelser som er tid- og kostnadsbesparende, som gir minst like god dokumentasjon av miljøstatus som dagens metode, og som muliggjør god miljøovervåkning også på lokaliteter med hardbunn. Prosjektet ledes av Prof. Knut Rudi ved NMBU og er finansiert av Norges Forskningsråd.
Bakgrunn
Miljøet i havet påvirker ikke bare større organismer, men også bakterier som utgjør en stor del av den totale biomassen. Ulike typer bakterier kan utnytte ulike energikilder og ved å innhente informasjon om hvilke bakterier man finner på havbunnen kan man altså si noe om miljøstatus.
For akvakulturlokaliteter med hardbunn finnes det pr. dags dato ikke en god metodikk eller standard som gir en miljøkartlegging som tilsvarer det vi har for bløtbunnslokaliteter. Både myndigheter og næringsaktører har etterlyst en metode som gir bedre kunnskap om miljøpåvirkning fra akvakultur på hardbunnslokaliteter. Vi foreslår en ny miljøstandard som benytter den mikrobiologiske statusen ved en lokalitet til å beskrive miljøstatus.
Slike analyser vil også kunne anvendes for å analysere miljøstatusen for bløtbunnslokaliteter og dermed vil analysene bli mer sammenlignbare enn det som er tilfelle i dag.
Dagens metoder
Dagens metode for miljøovervåkning av bunnpåvirkning fra marine akvakulturanlegg er basert på Norsk Standard 9410. Denne er revidert en rekke ganger fra første utgivelse i 2000. Revisjonene gjennomføres av en bredt sammensatt komite med bakgrunn fra forskning, fiskeri, miljømyndigheter, oppdrettere og konsulenter. Standarden inneholder tre undersøkelsestyper som alle har litt forskjellig innhold og omfang; forundersøkelser, B-undersøkelser og C-undersøkelser. I forundersøkelsen og C- undersøkelsen er makrofauna, altså de dyrene som bor oppå og i bunnsedimentene og som er større enn 0,1 cm, en sentral del av det som skal undersøkes. Dette gjennomføres i henhold til NS-EN ISO 16665.
Resultatene fra makrofauna undersøkelsene skal så behandles i henhold til klassifiseringsindekser som beskrives i vannportalens Veileder 02:2018 "Klassifisering av miljøtilstand i vann, Økologisk og kjemisk klassifiseringssystem for kystvann, grunnvann, innsjøer og elver". Etter dette kategoriseres lokalitetene i en tilstandsklasse fra I-V hvor I er "svært god tilstand" og V er "svært dårlig tilstand".
Flaskehalser
Flaskehalser knyttet til dagens metodikk for miljøovervåkning er som nevnt rapporteringstid og tilgjengelig kompetanse. Artsbestemmelse av makrofauna gjennomføres manuelt i laboratorier og dette er en tidkrevende prosess hvor resultatene foreligger først flere måneder etter prøvetaking. Det finnes også artskomplekser som kan bidra til at artsbestemmelsen blir utfordrende. For unge eksemplarer av en art, som ikke alltid har fullt utviklede karaktertrekk, kan det for eksempel være vanskelige å bestemme art. I tillegg er det en mangel på kompetanse innen artsidentifikasjon i Norge og det kreves mye tid og ressurser i forbindelse med opplæring av kvalifisert personell.
Nye DNA-metoder kan ikke per nå erstatte tradisjonell artsbestemmelse/taksonomi for kartlegging av miljøtilstand, men de kan bidra til å korte ned på tiden fra prøvetaking til analyseresultat. Ved kombinasjon av tradisjonell artsbestemmelse basert på makro-organsimer og DNA-baserte analyser av mikroorganismer, kan man med andre ord få en mer effektiv og treffsikker miljøkartlegging.
Samme metode for hard-og bløtbunn?
Prosjektet "On-site monitoring of aquaculture impact on the environment by open-source nanopore eDNA analysis" (AQUAeD) er et samarbeid mellom Aqua Kompetanse og STIM, Akvaplan-niva, Havforskningsinstituttet og NMBU. NMBU leder prosjektet som er finansiert av Norges Forskningsråd (2021-2025).
Formålet med AQUAeD-prosjektet er å utvikle et supplement og på lengre sikt et mulig alternativ til makrofauna analysene som utføres iht. dagens standard. Ved å gjennomføre en DNA-analyse av bunnprøver for å studere den mikrobielle sammensetningen, får man som nevnt nyttig informasjon om biokjemiske prosesser på lokaliteten. Metoden betegnes eDNA og den kan gi et mer direkte bilde av miljøtilstanden enn analyse av makrofauna.
Siden eDNA metoden er uavhengig av makrofauna er det interessant å undersøke om dette kan anvendes som en felles metode for både bløt og hardbunnslokaliteter. Hardbunnslokaliteter har i likhet med bløtbunnslokaliteter, ofte akkumulert organisk avfall som kan bidra til å endre bunnmiljøet. Det er med utgangspunkt i dette allerede utviklet en metode i New Zealand der bakterie-DNA benyttes til å reflektere status på havbunnen i forbindelse med akvakulturaktivitet (Keeley et al. 2018).
Tid- og kostnadsbesparende
En DNA analyse vil være tids- og kostnadsbesparende sammenlignet med tradisjonell metodikk. Miljøindekser basert på mikroorganismer kan genereres i løpet av noen få dager, og til en brøkdel av kostnadene ved tradisjonell analyse.
For å utvikle en tilleggsmetode for evaluering av miljøpåvirkning fra akvakultur, som kan benyttes på alle typer havbunn, forutsettes det at man etablerer en DNA-sekvensdatabase for alle bakterier som finnes i prøvene. Det finnes allerede funksjonsdatabaser for bakterier (FAPROTAX og GeneCodeID) som beskriver den metabolske prosessen som de ulike mikroorganismene vanligvis er assosierte med. Disse databasene vil bli brukt i vårt arbeide med å koble faktorene tilstedeværelse av en mikroorganisme og hvilken funksjon den kan ha i miljøet den befinner seg i. Arbeidet med å knytte bakterie DNA fra sedimentprøver mot eksisterende funksjonsdatabaser og sammenligne mot miljøtilstand fra tradisjonelle C-undersøkelser er allerede startet i prosjektet DigiMiba (RFF 285266). Her har man lovende resultater som ved sammenligning med tradisjonelle analyser for miljøtilstand i stor grad reflekterer de samme resultatene.
Prøvetaking langs kysten hvor det er oppdrettsaktivitet
I AQUAeD-prosjektet er vi som nevnt i gang med å samle inn og prosessere sedimentprøver fra hele kysten hvor det finnes akvakulturaktivitet. Planen er å dekke omkring 50 lokaliteter med omlag 1700 prøver. Disse prøvene blir basis for utviklingen av nye klassifiseringsalgoritmer og miljøpåvirkningsindekser. Eksisterende indekser og algoritmer utviklet for New Zealand vil bli undersøkt for å se om disse kan benyttes for norske forhold.
Diagnostiering på lokaliteten
En database med DNA-informasjon fra bakterier og klassifiseringsalgoritme åpner for muligheten til å utvikle en DNA teknologi som kan anvendes i felt. Denne teknologien heter nanoporesekvensering og er en annen metode for å bestemme DNA-sammensetning for ett og ett DNA-molekyl. Metodikken er ikke avhengig av et laboratorium med avansert og tungt utstyr. Fordi moderne laboratorieteknologi (på samme måte som mobiltelefoner) blir stadig mindre og enklere å bruke, handler en del av vårt prosjekt også om å undersøke hvor mye av laboratoriearbeidet og analysene det er mulig å gjennomføre i felt for å oppnå en mer effektiv karakteristikk av miljøforholdene. Med dette kan eventuelle tiltak settes i verk på et tidligere tidspunkt enn i dag. Dette vil spare miljøet for overbelastning samt bidra til redusertressursbruk for oppdrettsaktørene.

Substrat uavhengig prøvetaker
I AQUAeD vil det også bli gjort en evaluering av dagens metode for innsamling av bunnprøver. I dag anvendes en grabb for å hente opp bunnsediment/substrat i gjennomføring av de lovpålagte miljøundersøkelsene i oppdrett. En såkalt Substrate- independent benthic sampler (SIBS) vil bli benyttet for prøvetaking på bløtbunn og hardbunn. Ved å benytte SIBS kan en studere om man får samme resultat ved bruk av konvensjonelle grabb-prøver og "benthic sampler" prøver. Formålet er en optimalisering av prøvetaking og utvikling av en felles «beste praksis» for prøveinnsamling for alle bunntyper.

Prosjektet startet opp høsten 2021 og er godt i gang med prøveinnsamlingen langs norskekysten der hvor det finnes oppdrettsaktivitet. En stor del av prøvene er allerede ekstrahert for DNA og er under videre prosessering. Arbeidet med å teste utvinning av DNA i felt samt prøvetaking med SIBS på hard og bløtbunn, er planlagt gjennomført høsten 2022. Vi er i denne sammenheng i ferd med å etablere analyser ute i felt med bruk av nanopore sekvenseringsteknologien. De foreløpige resultatene er svært lovende, og vi ser for oss at dette arbeidet vil bidra til et "regime-skifte" innen miljøovervåkning av oppdrett.
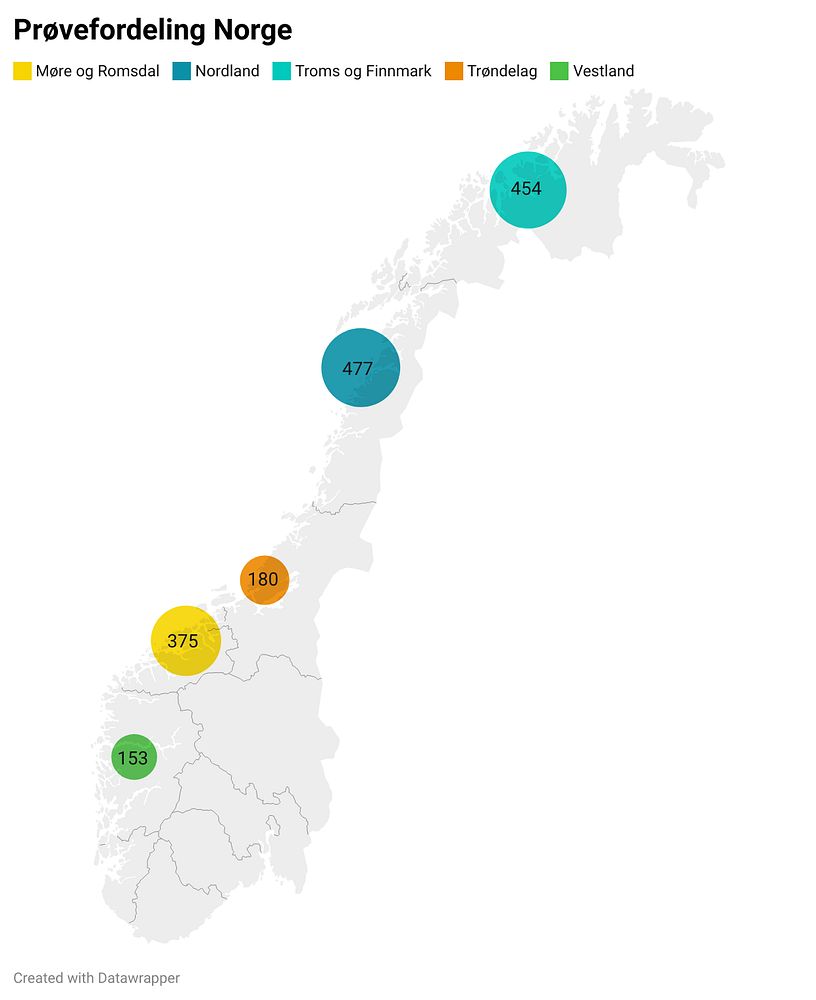
Oversikt over prøveinnsamlingen langs norskekysten
Av: Ragnhild Pettersen (Akvaplan-niva), Knut Rudi (NMBU), Anja Hervik (Aqua Kompetanse), Hans Petter Kleppen (STIM), Nigel Brian Keeley (HI), Inga Leena Angell (NMBU) og Morten Stokkan (STIM).
Artikkelen har også vært publisert i Norsk Fiskeoppdrett, nr. 9, 2022